
深圳XX科技有限公司成立于2011年,企业是集研发、生产、销售于一体的生产厂家。 公司位于的珠三角深圳宝安,有规范的生产线和内贸外贸销售团队。现主要生产中低频数码经络治疗仪、脉冲仪、视力保健眼护士、超身波美容仪、瘦身按摩仪、促销礼品等按摩保健产品。企业的产品广泛应用于:家用保健,理疗,美容,礼品,休闲等行业。企业秉承严谨、务实、精益求精的态度,力求不断研发生产适应市场需求的新产品、好产品,企业将以优良的品质,更良好的服务赢得市场。 本次获批产品为经皮电刺激仪(TENS)和肌肉刺激器(Muscle Stimulator),由BSI颁发认证证书(同时也是瑞恩尼助力获得的第20张MDR证书)。本次产品申请的主要难点在于临床评价与上市后临床随访(PMCF)。临床评价方面,等同性论证要求严格,需提供充分证据说明产品差异不会影响安全有效性,同时须具备足够且完整的资料以证实各适应症的安全有效性。对于PMCF计划,采用问卷调查形式。问卷设计需充分考虑家用场景及非专业人员的使用特点,在满足安全/性能终点、便于实施的前提下,尽可能减轻参与者的负担,确保调查的可行性与依从性。也恭喜企业获得欧盟医疗器械入场券,祝企业生意兴隆,马年大吉!
87
东莞某医疗器械有限公司成立于2016年,坐落于东莞长安。专注于医疗产品设计及制造,拥有专业且完整的开发产品和生产经验;产品主要出口英国和欧盟,其合作伙伴皆为全球知名医疗器械品牌。瑞恩尼本次助力企业获得一次性吸洗套件CE MDR(同时也是瑞恩尼助力客户获得的第19张)证书,也祝愿企业财源广进!!
129
深圳市某科技有限公司创立于2012年,是一家致力于家用医疗产品研发、制造、销售及售后服务为一体的高新技术企业。产品涵盖雾化器(压缩式、压电网式、直流压缩式),防褥疮气床垫,而氧仪、胎心仪、血压计等,业务遍及全球150多个国家,服务年均超过2000000个家庭。企业秉承用心缔造健康,致力于提升雾化方式的多元化,让家用医疗产品和现代医学科技惠及全球千家万户为理念,以尊重,包容,正直,高效,创新,执着为核心价值观,整合优势资源,以创新为发展之源,以科技为制胜之本,力争为每个消费者提供更专业,更先进,更安全的医疗产品。本次瑞恩尼助力企业获制氧机欧盟CE MDR证书(该证也是瑞恩尼助力企业获得的第18张),祝企业生意兴隆!
170
深圳某科技有限公司成立于2015年,经营范围包括一般经营项目:母婴用品制造;母婴用品销售;化妆品零售;家居用品制造;家居用品销售;医护人员防护用品生产(Ⅰ类医疗器械);第一类医疗器械销售;国内贸易代理;互联网销售(除销售需要许可的商品);照相机及器材销售;照相机及器材制造;家用电器研发;家用电器销售;电子产品销售;通讯设备销售。模具制造;模具销售;图文设计制作;专业设计服务;工业设计服务;工业工程设计服务。(除依法须经批准的项目外,凭营业执照依法自主开展经营活动)许可经营项目:第二类医疗器械销售;货物进出口;技术进出口;化妆品生产;医护人员防护用品生产(Ⅱ类医疗器械)。(依法须经批准的项目,经相关部门批准后方可开展经营活动,具体经营项目以相关部门批准文件或许可证件为准)本次瑞恩尼助力企业完成加拿大、日本、美国MDSAP体系的建立并成功获得MDSAP认证证书。
141
东莞市某电子科技有限公司,是一家专注于红外额温计,红外无接触体温计、电子体温计、电子血压计、雾化器等医疗器械产品的专业制造商。企业集方案开发,产品设计,成品制造,市场销售于一体,公司拥有10000多平方米的制造基地,配备现代化的生产流水线,拥有300多名训练有素的员工。 令人骄傲的是,企业拥有一个充满活力的研发技术团队。他们在电子医疗行业拥有超过10年的经验,他们始终站在医疗电子技术的最前沿,并孜孜不倦地将技术创新服务于普罗大众。并且,企业始终重视生产,品质,物流环节的控制,力求产品物美价廉。以上优势,不仅令企业的自有品牌有口皆碑,亦为客户化定制服务提供了得力的保障。企业已通过ISO13485认证,并取得医疗器械生产企业许可证。并且拥有多个产品的CE MDR证书和FDA 510k认证。 本次瑞恩尼助力企业获得了多个产品的CE MDR认证(该证也是瑞恩尼助力客户获得的第17张证),在此预祝企业产品大卖,销售长虹!
326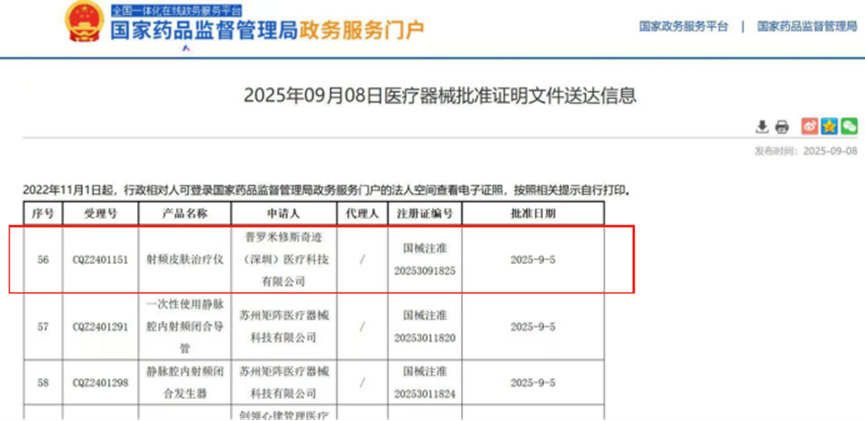
【喜讯】| 广州助医通助力又一家用射频皮肤治疗仪成功获批上市 2025 年 9 月 5 日,由普罗米修斯奇迹(深圳)医疗科技有限公司研制生产的第三类医疗器械“射频皮肤治疗仪”已正式获得国家药品监督管理局批准,注册证号:国械注准 20253091825。该项目由我司广州助医通医药咨询有限公司(下称“助医通”)全程负责整个临床试验全流程,从项目立项到结题,均由助医通独立负责。该项目是首个获批的手持式三功能(射频、LED与EMS)射频皮肤治疗仪。此次获批,标志着由广州助医通负责的临床试验服务的射频皮肤治疗仪的第二张证书被批准。 这不仅是对客户产品能力的肯定,也是间接对我司团队辛勤付出与团队专业能力的高度认可!以下是助医通对本次临床试验的经验分享: 一、项目背景 随着医美市场的扩大,我国相关部门也对医美行业进行了规范和监管,以确保医美行业的健康发展。2022年03月30日,国家药监局发布了关于调整《医疗器械分类目录》部分内容的公告(2022年第30号),对27类医疗器械涉及《医疗器械分类目录》内容进行调整。依据该公告的相关要求,射频美容设备明确按照第三类医疗器械管理。对于附件中调整涉及的09-07-02射频治疗(非消融)设备中射频皮肤治疗仪类产品,自公告发布之日起,需按《医疗器械注册与备案管理办法》(国家市场监督管理总局令第47号)的规定申请注册。自2024年4月1日起,射频皮肤治疗仪类产品未依法取得医疗器械注册证不得生产、进口和销售。自2024年4月1日起,未取得医疗器械生产、经营许可(备案)的企业,不得从事相关产品的生产和销售。 2023年04月,国家药品监督管理局医疗器械技术审评中心发布了《射频美容设备注册审查指导原则》,指导原则中关于射频美容设备的临床评价要求,应参照《医疗器械分类目录》子目录09“物理治疗器械”相关产品临床评价推荐路径开展临床评价。推荐采用临床试验路径开展相关评价。 在此行业监管升级的关键节点,助医通凭借专业口碑承接了普罗米修斯奇迹(深圳)医疗科技有限公司的委托,全权负责其射频皮肤治疗仪的临床试验项目,充分体现了申办方对助医通的深度信任。 二、项目里程碑 该项目临床试验自从方案设计定稿至发布试验总结报告,临床试验历时约1年。从项目初期的临床试验方案设计——团队联合多位医美临床专家、数据统计师开展多轮论证,反复优化纳入/排除标准、评价指标及样本量计算模型,确保方案既符合《射频美容设备注册审查指导原则》要求,又具备临床可操作性;到中心筛选与调研,先后考察全国多家三级医院的医美科室,最终确定2家符合要求的临床中心;再到伦理审批阶段,积极配合医院伦理要求递交资料,1个月内完成组长单位伦理上会并通过审批;以及后续的中心启动会组织、受试者全周期管理(项目累计随访脱落率仅1.4%)、第三方稽查配合(无重大质量问题)、数据统计分析,直至总结报告撰写与注册资料提交,每一个环节都凝聚着助医通团队的心血。 项目推进过程中,由于手持式射频皮肤治疗仪为首次划归医疗器械监管,在中国既没有临床专家共识,也没有可参考的临床先例。在方案设计和审核的过程中,相关多方积极沟通和配合,顺利完成了所有的临床试验与审核答疑,最终获得批准。 三、项目大事记 2024年11月底,该项目迎来国家药监局现场核查。助医通派出全部试验参与人员全程驻场协助,提供专业技术支持与流程配合,确保核查工作高效顺利通过,进一步印证了团队的专业能力与负责态度。 图1:国家相关监管部门现场核查欢迎会 图2:助医通团队人员协助现场核查 GCP检查的通过,标志着助医通的临床试验过程符合规范、科学的原则,经得起相关方与监管方的审核。这是一个证明助医通临床管理规范性的例子,同时也是一个良好的开始,还是后续其它更多临床试验项目的参考范例,更是以后前进与不断完善的标志。 三、结语 一款医疗器械的成功获批,离不开申办方、临床研究单位、 CRO和SMO团队的协同攻坚。助医通有幸作为关键参与方,用专业服务申办方及临床研究单位,未来将持续发挥CRO临床服务及注册的专业优势,助力医美行业发展! 在创新医疗器械从实验室走向市场的征程中,我们深知企业面临的挑战:复杂的法规、严谨的临床验证、漫长的审批周期。我司作为一家深度垂直的医疗器械CRO服务机构,愿成为您最可靠的战略伙伴,提供从研发规划到成功注册的全周期解决方案。 前瞻规划,降低风险: 在产品研发初期,我们即介入进行注册策略咨询与临床路径规划,为您厘清方向,避免技术审评阶段的致命缺陷。 高效执行,保障质量: 我们拥有强大的专家团队和执行网络,提供临床试验一站式管理服务,包括方案设计、中心筛选、伦理报批、监查稽查、数据管理与统计,确保试验过程合规、数据坚实。 成功申报,完美收官: 我们精通注册法规,能为您高效撰写和整合临床评价报告(CER) 等关键申报资料,并提供专业的迎检辅导,大幅提高注册成功率。 我们不仅交付项目,更交付成功和安心。凭借以往项目的成功案例,我们承诺将以最高的专业标准和最负责的态度,全程护航,助力您的创新产品早日上市,造福患者,赢取商业成功。 目前助医通在开展的临床试验项目包括了IPL脱毛仪、助听器、HIFU产品、血氧等。助医通拥有专业丰富经验的的临床试验团队,包括PM、临床医学、统计、CRA与SMO等。 立即联系我们,获取专属上市解决方案!
525