
恭喜瑞恩尼2个月内获得电动吸鼻器的美国FDA510(K)批准,再次刷新快获批美国FDA510(K)的纪录! 电动吸鼻器一般由:主机和吸引组件组成,是一种用于去除儿童的鼻腔分泌物和粘液的产品。在美国按照医疗器械进行监管。 瑞恩尼于2022年4月受客户委托办理其公司的电动洗鼻器FDA510(K)。在获得产品输入资料后编写完成FDA510(K)申请资料,于2022年8月23日向FDA官方递交全套申请资料。在整个审核过程中非常顺利,交互审核时对于几个手误以及审核员不清楚的地方做了解释说明之外,未产生其他的发补问题。于2022年10月21日收到来自FDA官方的批准函。整个递交到批准历时不超过2个月。 瑞恩尼不负客户所托!精准把握产品特征,掌握FDA法规要求是快速获得FDA510(K)批准的条件。专业、专注、专心的理念更是获得认证成功的关键。
53
近日,深圳爱奥乐医疗器械(深圳)有限公司的血糖仪和血糖试纸(葡萄糖脱氢酶法)产品,在深圳瑞恩尼的助力下荣获广东省药品监督管理局颁发的医疗器械NMPA注册证,血糖监测再增新成员! 在此,瑞恩尼分享血糖仪和血糖试纸在NMPA注册审核过程中需要注意的一些地方:
53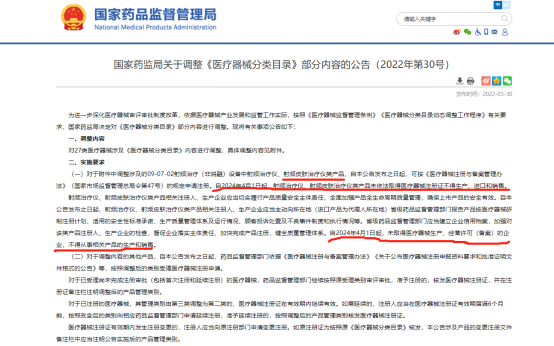
背景介绍 随着国内民众的生活水平不断提高,人们对于美的追求空前高涨。基于市场需求,衍生了一大批家用美容器械,如IPL脱毛仪,光疗产品,射频美容仪,热吉玛等。基于这一市场的需求变化,为合理控制美容器械的风险,食品药品监督管理局逐渐在参考美国FDA监管模式,将美容器械当作医学美容器械分批纳入医疗器械范围进行管理。 2022年3月局正式发文通知,要求将射频美容仪划入医疗器械监管,并于2024年4月1日起正式按医疗器械许可入市。 同步,在2022年4月局发布关于征求《射频美容类产品分类界定指导原则》(征求意见稿)意见的通知。将射频美容类器械分为如下: 2022年7月局正式对射频类美容产品提出了分类界定意见: 医学美容是医疗器械发展一个新的机遇与风口,基于此广东省发布了关于支持医学美容行业发展的相关意见--《广东省卫生健康委办公室关于征求我省医疗美容外科项目及其分级管理目录意见的函》(以下简称“征求意见稿”)。 随着中国的经济增长与消费升级,中国的医美行业发展迅速,市场规模已跃居第二,行业发展空间大,市场竞争激烈。中国医疗美容市场的市场规模由2017年的993亿元增至2021年的1891亿元,年复合增长率为17.5%。中国医疗美容市场的增长率远高于总市场,预计2022年中国医疗美容市场的市场规模将达2267亿元。 第二节:强强联合 瑞恩尼咨询在医疗器械咨询业从业9年,具有丰富的医疗器械国内与国际注册经验。目前具有全职咨询师20人,具有完整的项目服务能力(包括国内与国际市场的设计评审,厂房规范,注册代理,体系辅导,临床试验,生产许可以及教育训练、长期顾问服务)。 本次射频皮肤治疗仪NMPA注册的客户成立于2003年,是国内较早一批专注于医美行业的高新企业。企业具有众多高素质人才,在设计开发、质量管理,生产制造方面具有较强的实力,为国内外一线品牌进行ODM与OEM服务。 在医美企业的大背景下,客户企业结合自身发展需求,决定开展III类射频皮肤治疗仪产品的注册。客户在经过对多家咨询企业进行多轮会谈与比例后,终选择了瑞恩尼咨询。本次注册项目是瑞恩尼在医美器械上重要的“标志性三类医疗器械注册项目”,瑞恩尼立志要将该射频项目做成企业服务的金样板。它标示了瑞恩尼在2022年里发展的重要的一段里程碑;也标志着瑞恩尼向更高更快更专业的方向积极前进。该项目对瑞恩尼具有重要的战略意义。 项目启动会伊始,客户项目代表发表了热烈地讲话。过程中客户代表从企业自身诠释了本次注册项目的战略意义,以及企业即将面临的挑战和机遇。 瑞恩尼创始人王总,也受邀致辞。从产品注册难度、注册计划、项目服务小组等多方面概括了本次项目,获得了客户的热烈掌声。 会议末尾,瑞恩尼创始人(下图左)与客户企业总经理(下图右)签订了《射频皮肤治疗仪NMPA注册代理咨询合同》,本次项目正式启动。 第三节:展望 项目签订后,接下来将是瑞恩尼项目组全体人员参与服务的过程。相信在双方的互信、精诚的合作与努力下,可以在目标计划内获得III类的产品注册证与生产许可证。 未来获得喜讯时,我们将再次发表文章向大家报告喜讯!!!
53
机用根管锉是一种牙科旋转器械,需要配合牙科手机使用,通过牙科手机提供动力。由柄和头部工作端组成,机用根管锉本体为镍钛合金,工作端带有刻纹或螺旋刃口,用于齿科治疗中根管预备、辅助充填(即对牙骨、根管等的切削、平整、清洁和塑形等)。机用根管锉由操作部和杆构成,在操作部上有带切削刃的工作部;操作部由镍钛合金材料制成。 目标用户:产品必须由受过正规根管治疗训练的牙科医生使用。该产品预期使用地点为医疗机构、牙科诊所及类似场合。 我司于2021年12月底受客户委托办理其公司的机用根管锉NMPA二类医疗器械首次注册。历时7个月,瑞恩尼不负客户所托,在2022年7月1日收到注册证批件。(批准日期:2022年6月29日,注册证号:粤械注准20222170852) 经过此次注册,有几条经验分享给大家: 1)[敏感词]步,首先将根管锉按照其形状进行分类。机用根管锉的种类复杂,按照[敏感词]形状和锥度分别有:标准器械、锥形器械、成型器械、非锥形器械、以及非单一锥度器械器械之分。不同的分类所对应的标准要求也是不同的。 2)第二步,根据根管锉的类型在适用标准内也要进行仔细辨别。即使是同一个标准,也要根据根管锉的不同类型对每个标准章节进行仔细辩证。 3)总体来讲,从机用根管锉行业的专业角度来看,根管锉适用的YY0803序列标准存在许多不足之处。就部分内容而言,大部分已上市的产品其实也并不符合YY0803序列标准的部分要求。而从评审老师的角度来看,强制性要求又是必须符合的。那么,如何去解决这些矛盾性的难题,是目前面临的挑战。 4)本次注册根管锉的型号规格众多,注册型号就有56个,不同型号又细分了几十种规格。其产品检测及出具测试报告也是非常考验人耐心的。在省所检测时,省所认为型号规格庞大只愿意出三个主检型号的测试报告,其余所有的规格差异型号需要厂家自行出具。所幸遇到政策改变,药监局可以认可企业的自测报告。这样大大的节省了产品的检测时间。 综上,根管锉NMPA注册需要重点关注标准的条款符合性,以及同类对比产品的一致性。
53
嵘丰吸奶器获得FDA510K认证批准 K212884 电动吸奶器在美国属于二类医.疗器械,产品需要符合美国FDA对于医.疗器械的要求。 电动吸乳器的目的是为了让哺乳期的妇女分泌和收集乳房中的乳汁。它是为单个用户设计的。 电动吸奶器通过吸吮附件在乳头周围形成一个密封区,密封区内的空气被气泵抽走,形成真空从而对乳房施加吸力,然后释放吸力刺激泌乳及吸出乳汁。奶水被收集在奶瓶中。 由于工作的繁忙,越来越多的哺乳期妇女选择哺乳期参与工作,电动吸乳器使用安.全卫生便捷,嵘丰选择委托我们办理其公司的美国FDA510K认证注册。瑞恩尼不负客户的委托,在在2022年的年初完成了FDA510K认证的批准。 经过此次注册,需要分享的有几条经验有: 1)吸奶器的适用于哺乳期的妇女,单一病人使用,使用前需要清洁和消.毒; 2)真空负压压力的测试需要保障在运行过程中进行测试; 3)吸奶器的使用说明需要符合美国疾控中心的要求。
53
指夹式血氧仪在美国是一种处.方.医.疗.器械,其主要用途为通过无创法测量手指指尖部位来测量血氧饱和度SpO2以及脉博。 由于血液中的血红细.胞,其中含氧血红蛋白(HbO2)和还原血红蛋白(Hb)这两种血红蛋白对红光(660nm)和红.外.线.(910nm)有不同的吸收能力。还原血红蛋白(Hb)吸收的红光较多,红.外.线.较少。而含氧血红蛋白(HbO2)则相反,它吸收的红光较少,红.外.线.较多。通过在指甲式血氧仪的同一位置设置红光LED和红.外.线.LED灯,当光线从手指的一面穿透到另一面,被光敏二极管接收后,可产生对应比例的电压。经过单片机处理,将输出结果显示在液晶显示屏上。 在疫情期间其与口罩,体温计,制氧机,呼吸机同为防疫五大件。所以在疫情期间大量的企业争相注册血氧仪的认证以出口欧美。领新公司在通过与多家同行进行比对后,终被我们的专.业与真诚所打动,选择委托我们办理其公司的欧盟CE以及美国FDA510K认证注册。瑞恩尼不负客户的委托,在2021年上半前完成了其CE认证的通过,在2021年的年底期间完成了FDA510K认证的批准。 经过此次注册,需要有几条可以分享的经验有: 1)确认产品是否宣称适用于儿童?如果适用于儿童,临.床精度测试需要考虑到适当样本;同时还要考虑连续使用的时间,防.止手指长期受压造成的血液不循.环问题; 2)确认产品是否要用于低灌注情形?如是,要考虑标准或指南对此的具体要求; 3)如果产品有无线功能,APP的设置与产品的整体规划需要满足相关国.家网络安.全的基本要求; 4)建议临.床精度测试与咨询机.构..好.选择同一家,避免相互之间扯皮;临.床测试要满足GCP的程序要求; 5)产品超过有效的量程范围,应该显示报警提示,同时不应显示超过有效量程范围外的数值,避免对用户造成误解。 6)许多企业的血氧仪是采购方案商的,一定要确认方案商的产品在市场的成熟度。许多方案商的设计并没有经过实际的临.床验证,导致在低血氧端容易出现测量不准。同时在认证的过程中,需要方案商能得到快速的响应(如需要修改软件或设计.时),才能确保认证快速的通过。
53