
根据2020年9月30日发布的《国家药监局 国家卫生健康委 国家医保局关于深入推进试点做好第一批实施医疗器械唯一标识工作的公告》(2020年 第106号),2021年1月1日将全面启动第一批医疗器械唯一标识实施工作。
按照《国家药监局关于做好第一批实施医疗器械唯一标识工作有关事项的通告》(2019年第72号)有关要求,对于列入《第一批实施医疗器械唯一标识的产品目录》(见附件)中的医疗器械,申请首次注册、延续注册或者注册变更时,申请人或注册人应当在注册管理系统中提交其最小销售单元的产品标识(以下简称UDI-DI)。现将UDI-DI提交的有关事宜通告如下:
一、2021年1月1日起,对于列入《第一批实施医疗器械唯一标识的产品目录》的医疗器械,申请人或注册人在eRPS系统提交医疗器械产品注册、延续注册或者注册变更事项的申请表时,应按照页面提供的模板填写并上传UDI-DI相关信息。
二、2021年1月1日起,对列入《第一批实施医疗器械唯一标识的产品目录》的医疗器械,未按照上述要求在申请表中填写UDI-DI的,申请表无法提交,注册申报资料不予签收。
三、UDI-DI不属于注册审查事项,由申请人或注册人按照《医疗器械唯一标识系统规则》创建。
四、申请表其他附件的提交要求保持不变。
特此通告。
第一批实施医疗器械唯一标识的产品目录
依据《医疗器械分类目录》列出以下品种:
一、01有源手术器械
二、02无源手术器械
三、03神经和心血管手术器械
四、06医用成像器械
五、10输血、透析和体外循环器械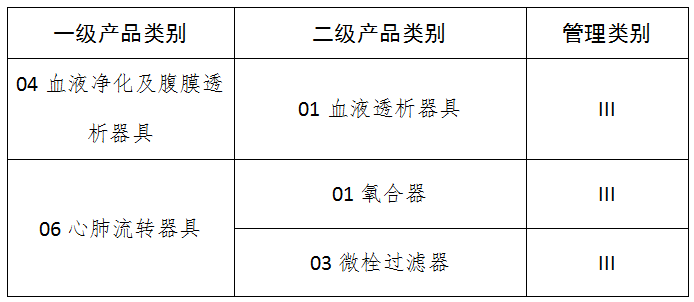
六、12有源植入器械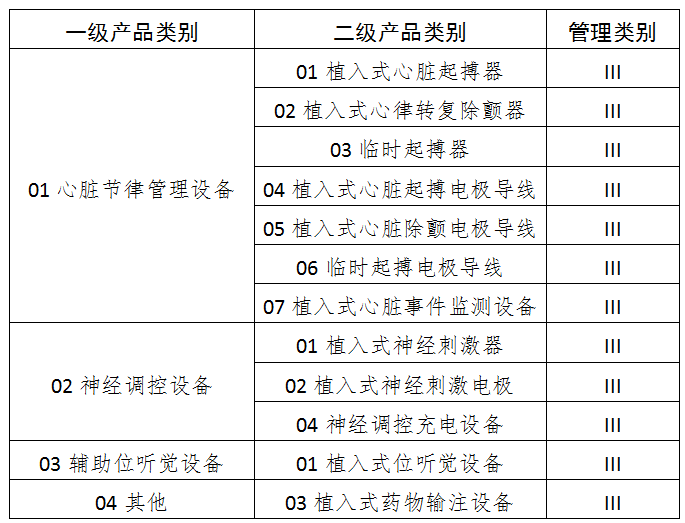
七、13无源植入器械
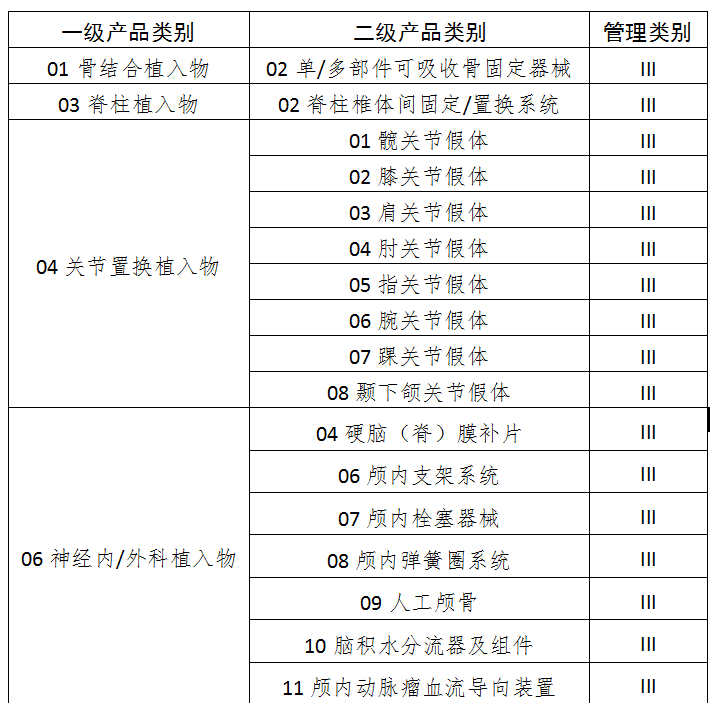
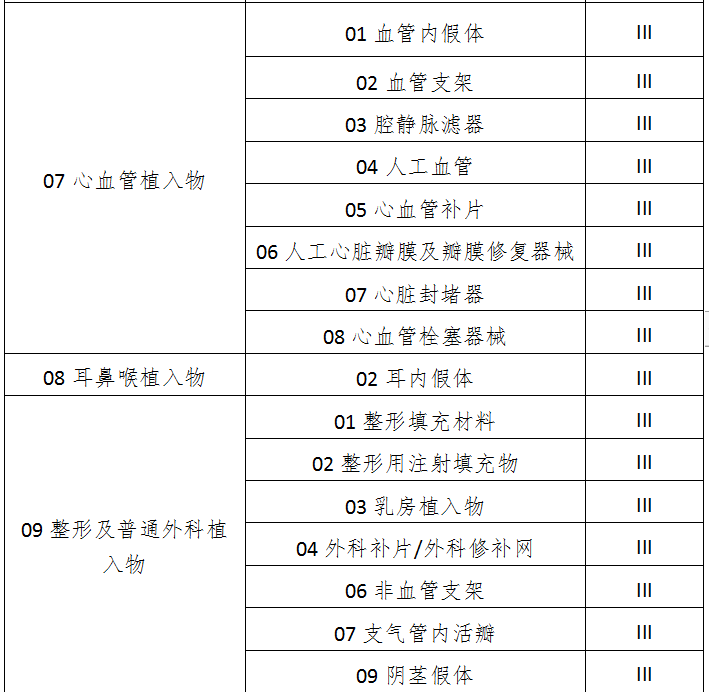
八、14注输、护理和防护器械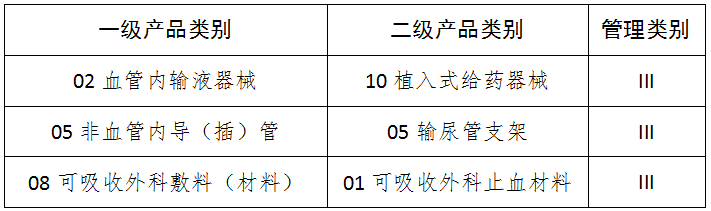
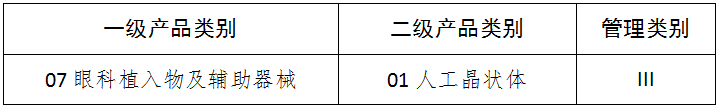
九、16眼科器械
Parent Company:
Shenzhen Reanny Medical Device Management Consulting Co.,Ltd
Address:Room 1407, Jingting Building, Dongzhou Community, Guangming Street, Guangming District, Shenzhen
Guangzhou Branch:
Guangzhou Reanny Medical Device Consulting Co., Ltd
Address:No. 2205, West Block, Building K, Kehui Jingu, No. 99, Kexue Avenue, Huangpu District, Guangzhou

扫一扫,关注我们
