
美国食品和药物管理局(Food and Drug Administration)简称FDA,FDA 是美国政府在健康与人类服务部 (DHHS) 和公共卫生部 (PHS) 中设立的执行机构之一。作为一家科学管理机构,FDA 的职责是确保美国本国生产或进口的食品、化妆品、药物、生物制剂、医疗设备和放射产品的安全。它是最早以保护消费者为主要职能的联邦机构之一。 通过FDA认证的食品、药品、化妆品和医疗器具对人体是确保安全而有效的。在美国等近百个国家,只有通过了FDA认可的材料、器械和技术才能进行商业化临床应用。
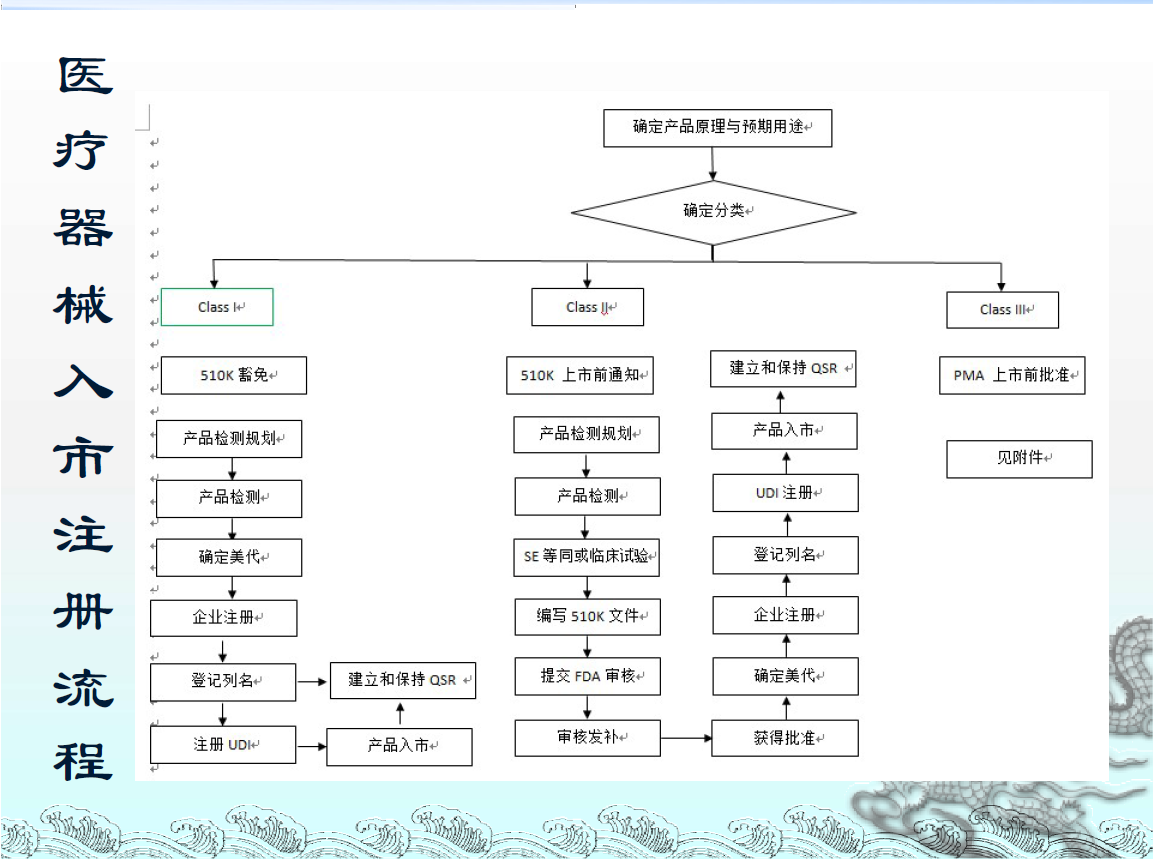
美国FDA要求所有从事生产、配制、传播、合成、组装、加工或进出口医疗器械的企业必须在FDA进行注册,而针对II类、III类风险等级较高的医疗器械还需要提供510(K)报告。
510(k),是美国食品、药品和化妆品(FD&C)行动委员会的一个法案章节,根据这个章节的法案要求,凡是把法规规定的器械引入美国市场时,都必须满足该法案的要求,那些不豁免510(k)的Ⅰ、Ⅱ、Ⅲ类医疗器械,都必须做“产品上市登记”,这个产品上市登记,就是我们通常所说的FDA 510(k)注册。
21 CFR 860医疗器械分类程序(FDA医疗器械分类):
一类进行一般的管理就能对其它全性和有效性和有效性提供适当的保证;尽管没有充分的资料能判定如上所述情况,也没有资料能证明要保持其安全和有效要建立特别的控制点,但是该器械的使用不具有维持和延续人类生命的作用,也不对人体健康受到损害有重妥性,而且不存在潜在的不合理的疾病和伤害风险。如:电动牙刷、加湿器、给药器
一类上市方式绝大部分510K豁免或小部分510K
二类指最终需要进行特殊控制的器械。有充足的资料证明需要建立对其特殊控制,包括颁布性能标准、上市后的监督、病人的登记、发展和指导文件的传播。对于声称或标明用于支持和延续人类生的器械,专员应检查和确定特别控制点来充分保证发全性和有效性。如:体温计、注射器、血压计等
二类上市方式绝小部分的510K豁免;绝对大部510K;小部分的PMA
三类类没有足够资料能够说明采用一般控制,或者如二类器械所述的特别控制可以充分保证器械的安全性与有效性,同时该器械具有支持生命和延续生命的功能、对防止损坏人体健康有非常重要的作用,或是器械有潜在的不合理的疾病或伤害风险。如骨生长的超声设备,可吸收材料、植入式心脏起博器
三类上市方式绝小部分的510K;绝对大部的PMA
美国FDA认证注册是没有证书的,产品通过在FDA进行注册,将取得注册号码,FDA会给申请人一份回函(有FDA行政长官的签字),但不存在FDA证书一说。中国申请人在进行FDA注册时必须指派一名美国公民(公司/社团)作为其代理人,该名代理人负责进行位于美国的过程服务,是联系FDA与申请人的媒介。
FDA注册流程图:
Parent Company:
Shenzhen Reanny Medical Device Management Consulting Co.,Ltd
Address:Room 1407, Jingting Building, Dongzhou Community, Guangming Street, Guangming District, Shenzhen
Guangzhou Branch:
Guangzhou Reanny Medical Device Consulting Co., Ltd
Address:No. 2205, West Block, Building K, Kehui Jingu, No. 99, Kexue Avenue, Huangpu District, Guangzhou

扫一扫,关注我们
