
唯一器械标识(Unique Device Identification,缩写UDI)是对医疗器械在其整个生命周期赋予的身份标识,是其在产品供应链中的唯一“身份证”,由数字、字母或者符号组成的代码,用于对医疗器械进行唯一性识别。
一、实施时间
中国UDI实施时间:
NMPA在2019年发布了《关于发布医疗器械唯一标识系统规则》的公告,并告知自2019年10月1日起施行。接着在同年10月发布《关于做好第一批实施医疗器械唯一标识工作有关事项》的通告。通告中确定部分有源植入类、无源植入类等高风险第三类医疗器械作为第一批医疗器械唯一标识实施品种。心脏起搏器、髋关节假体、整形用注射填充物等九大类64个品种被列入第一批实施医疗器械唯一标识的产品目录。而其他不在目录中的暂未明确具体实施时间。
欧盟UDI实施时间:
1)根据医疗器械法规MDR(Regulation (EU) 2017/745):
对于可植入器械和III类器械,自2021年5月26日起适用;
对于IIa和IIb类器械,应自2023年5月26日起适用;
对于I类器械,应自2025年5月26日起适用。
2)根据体外诊断产品法规IVDR(Regulation (EU) 2017/746):
对于D类器械,自2023年5月26日起适用;
对于B类和C类器械,应自2025年5月26日起适用;
对于A类器械,应自2027年5月26日起适用。
美国UDI实施时间:
III类医疗器械的标签和包装、以及公共卫生署法案许可的设备,需在2014年9月24日起实施。
植入设备、生命支持和维持设备(II类、I类及未分类的医疗器械),需在2015年9月24日起实施。
II类医疗器械(除植入型、生命支持型及维持生命型的医疗器械除外,)需在2016年9月24日起实施。
I类设备及没有进行分类的设备,需在2018年9月24日起实施。
二、发码机构
中国UDI发码机构:
a) 中国物品编码中心:主要基于GS1系统,也就是原来的商品条码相关系统,具有国际化条件。同时GS1系统也是符合《ISO/IEC 15459 供应链单品管理中统一标识系统》的编码方案。可以采用的数据载体为:一维条码、二维条码、RFID。
b) 中关村二维码研究院:主要基于国际自动识别协会(AIM)分配给其的MA标头(ISO/IEC 15459的编码体系中的IAC概念)。虽然具有国际化潜力,但是现在由于其自己制定的编码方案已经不符合ISO/IEC 15459编码以及与之相配套的应用规则(详见ISO/IEC 15459 第三部分的规定),所以只能算作是中关村二维码研究院的一个私有/闭环编码仅能作为国内使用。可以采用的数据载体为:二维条码、部分一维条码(需要识别设备或者应用系统另行开发接口支持)。
c) 阿里健康:主要采用的是阿里自己制定的编码结构,是阿里自己的闭环应用方案,全部由阿里自己提供支持。可以采用的数据载体为:二维条码、部分一维条码。
欧盟UDI发码机构:
d) 国际物品编码协会GS1 AISBL
e) 保健业商务通信委员会Health Industry Business Communications Council (HIBCC)
f) ICCBBA
g) 国际血库自动化委员会德国制药市场信息服务提供商Informationsstelle für Arzneispezialitäten — IFA GmbH
美国UDI发码机构:
a) 国际物品编码协会 (Globe Standard 1, GS1)
b) 保健业商务通信委员会 (Health Industry Business Communications Council, HIBCC)
c) 国际血库自动化委员会 (International Council for Commonality in Blood Banking Automation, ICCBBA)
根据以上机构,无疑建议首选GS1作为发码机构。
三、UDI编码组成
在国际统一标准下,GS1、HIBCC、ICCBBA 完整的编码由器械标识(Device Identification,DI)和(或)生产标识(Production Identification,PI)组成。(如下表所示):
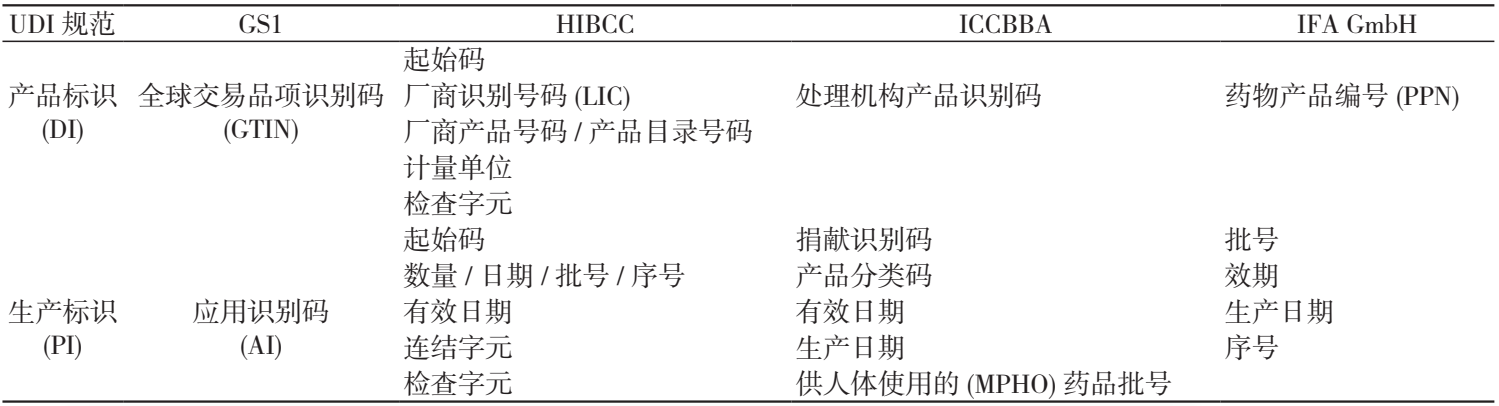
IFA GmbH 编码由 Basic UDI-DI 对具有某些相同属性的制造商产品进行分组编码,特定医疗器械UDI 由 DI、PI 部分组成。
DI是UDI的必须、固定部分,由企业识别码和产品规格码两部分组成。企业识别码由企业向发码机构申请,并分配全球唯一的企业识别码;产品规格码包括商品信息(如产品型号、规格),包装信息和校验码。由企业标识码和产品规格码组成的DI是全球唯一的。
PI是医疗器械唯一标识的可变部分,包括生产日期、失效日期、批号或序列号等。
四、载体要求
中国UDI载体:
医疗器械唯一标识数据载体应当满足自动识别和数据采集技术以及人工识读的要求。如空间有限或者使用受限,应当优先采用符合自动识别和数据采集技术的载体形式。
自动识别和数据采集技术包括一维码、二维码或者射频标签等形式,鼓励采用先进的自动识别和数据采集技术。
采用一维码时,可将产品标识和生产标识串联,也可多行并联;采用射频标签时,应当同时具备一维码或者二维码。
当前市面上常用的数据载体包括一维码、二维码和射频标签(RFID)。
一维码是只在一维方向上表示信息的条码符号,应用多年已经很成熟,成本低,能很好兼容市面上现有的扫码设备,但一唯码所占空间大,破损纠错能力差。
二维码是在二维方向上都表示信息的条码符号,相比于一维码,相同空间能够容纳更多的数据,在器械包装尺寸受限的时候能发挥很好的作用,具备一定的纠错能力,但对识读设备的要求相较于一维码要高。
射频标签具有信息存储功能,能接收读写器的电磁调制信号,并返回相应信号的数据载体。射频标签的载体成本和识读设备成本相较于一维码和二维码要高,但RFID读取速度快,可以实现批量读取,在某些环节和领域能够发挥作用。
注册人/备案人可根据产品的特征、价值、主要应用场景等因素选择适当的医疗器械唯一标识数据载体。
欧盟与美国UDI载体:
对于在欧盟单独包装和标记的I和IIa类一次性器件:条形码可应用于包含多个独立包装器械的上一级包装(适用于美国的所有类别)。如果healthcare providers无法访问更高级别的设备包装(例如用于家庭护理的设备),则不适用此方法。
可重复使用的设备在设备上直接标记,在美国和欧盟都有一些豁免。不同的是,美国允许条形码或HRI或两者都要直接标记,但不要求两者都标记,而欧盟要求条形码和HRI两者都标记。
在欧盟,在严重的空间限制的情况下,条码格式(不是HRI)应优先考虑,除非该设备打算在卫生机构之外使用(例如用于家庭护理的设备)。
在欧盟,有源植入物需要序列号。序列号或批号允许用于其他植入物。
Parent Company:
Shenzhen Reanny Medical Device Management Consulting Co.,Ltd
Address:Room 1407, Jingting Building, Dongzhou Community, Guangming Street, Guangming District, Shenzhen
Guangzhou Branch:
Guangzhou Reanny Medical Device Consulting Co., Ltd
Address:No. 2205, West Block, Building K, Kehui Jingu, No. 99, Kexue Avenue, Huangpu District, Guangzhou

扫一扫,关注我们
