
什么是UDI
医疗器械唯一标识UDI(Unique Device Identification,缩写UDI)是由美国食品药品监督管理局FDA于2013年9月24日正式发布建立的一套针对医疗器械的编码系统,旨在通过全球统一标准对医疗器械在其整个生命周期赋予唯一的身份标识,是其在产品供应链中的唯一“身份证”。
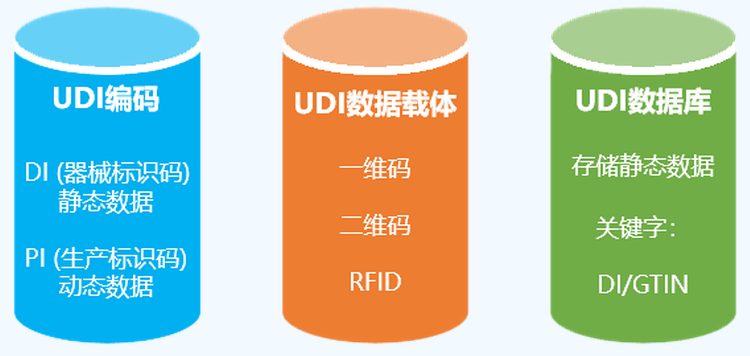
UDI是一串数字或字母组成的编码,由两部分组成,DI和PI,DI为固定信息(厂商及型号),PI为生产信息(批号、序列号、有效期、生产日期等)。
UDI法规要求
UDI规则要求器械在其标签和包装上带有UDI,除非有例外或替代应用,以及特殊的标签要求适用于作为器械管理的独立软件。UDI规则还要求,必须向FDA的GUDID数据库提交与每个需要携带UDI的设备的关键特性相关的数据。此外,UDI规则增加了21 CFR 801.18,要求设备标签上的特定日期采用标准格式。
最终规则中规定的监管要求的阶段性实施是基于一系列确定的符合日期,主要基于设备分类,从2014年9月24日到2022年9月24日9年内实施。
序号 | 强制日期 | 执行要求 |
1 | 2014 年 9 月24 日开始 | -所有 FDA Class III 第三类医疗器械 ; -FDA PHS Act 法案管制的器械 , 都必须在器械的标签和包装上标注 FDA UDI 信息; -FDA Class III 独立软件(Stand-alone Software) 必须提供 UDI 信息 |
2 | 2015 年 9 月24 日开始 | -植入式医疗器械,用于生命支持和维持的医疗器械(Implantable, life-supporting, and life-sustaining devices)的标签和包装都必须标注 UDI 信息,并采用 FDA 规定的日期格式; -如果上述植入式医疗器械,用于生命支持和维持的医疗器械为重复使用器械并在使用前要被再处理,那么必须进行永久性 UDI 标识; -用于生命支持或维持器械的独立软件必须标识 UDI |
3 | 2016 年 9 月24 日开始 | -UDI 管制的 Class III 可重复使用并且在使用前要再处理的医疗器械都需要进行永久性UDI 标识; -FDA Class II 二类器械的产品标签和包装必须标识 UDI ,并采用 FDA 规定的日期格式; -FDA 作为第二类别管制的独立软件必须标识 UDI |
4 | 2020年9月24日开始 | -FDA Class II 可重复使用的并且使用前可以被再处理的 FDA 管制的二类器械必须进行永久性 UDI 标识; -FDA Class I 一类医疗器械和未被划分级别 Class I, II 或 III 的器械都必须标识 UDI ; -所有这些器械,包含豁免 UDI 的器械,日期标注都必须符合 FDA 规定的日期格式要求; -FDA Class I 一类的独立软件必须提供 UDI |
5 | 2022 年 9 月24 日开始 | -FDA Class I 一类器械和未被分类为 Class I, II, III 的器械,如果可以重复使用和使用前要被再处理,都必须在产品上进行永久性 UDI 标注 |
注意:在这个强制日期前生产以及贴好标签的器械,可以不需要执行FDA UDI要求,这个豁免只能在生效强制日期后三年内采纳。超过三年一律要执行。 | ||
UDI发布机构
目前FDA授权三个代理机构可以颁发UDI编码:GS1,HIBCC,ICCBBA,三个代理颁发机构的UDI编码会有所不同,但都是FDA批准核实的编码规则:
FDA认可的发布机构名称 | 相关信息 |
GS1 | 地址:Princeton South Corporate Center300 Charles Ewing Blvd.Ewing, NJ 08628 |
网站:https://www.gs1.org | |
邮箱:gs1usudi@gs1us.org | |
Health Industry Business Communications Council (HIBCC) | 地址:2525 E. Arizona Biltmore Circle, Suite 127Phoenix, AZ 85016 |
网站:https://www.hibcc.org | |
邮箱:allisonmehr@hibcc.org | |
ICCBBA | 地址:PO Box 11309San Bernardino, CA 92423-1309 |
网站:https://www.iccbba.org | |
邮箱:erwin.cabana@iccbba.org |
目前,美国第三类和第二类医疗器械产品已经全部实施UDI,而第一类和未分类医疗器械将于2022年9月24前不予实施。在实施UDI过程中,FDA成立了专门的UDI小组,并建立了UDI咨询系统(UDI Helpdesk),以解答企业在实施中遇到的相关问题。FDA在2013年9月法规发布时开放了数据库上传功能,并于2015年5月对公众开放。截至今年2月,该数据库已经有超过200万条主数据。
Parent Company:
Shenzhen Reanny Medical Device Management Consulting Co.,Ltd
Address:Room 1407, Jingting Building, Dongzhou Community, Guangming Street, Guangming District, Shenzhen
Guangzhou Branch:
Guangzhou Reanny Medical Device Consulting Co., Ltd
Address:No. 2205, West Block, Building K, Kehui Jingu, No. 99, Kexue Avenue, Huangpu District, Guangzhou

扫一扫,关注我们
