
受到新冠肺炎疫情影响,欧盟医疗器械法规(MDR)推迟一年至2021年5月26日执行;所有新器械的制造商及其利益相关者必须在2021年5月26日之后需符合MDR新的相关要求;制造商应在过渡期内更新技术文件和流程以满足法规要求。下面将讲述如何从MDD认证过渡到MDR认证:
第一步:
研读MDR法规,参加MDR法规培训,深圳市瑞恩尼医疗器械管理咨询有限公司面向广大客户提供MDR法规培训服务。
第二步:
MDR跟新了医疗器械的分类规则,制造商需要重新按照MDR的分类规则对自己的产品进行重新分类
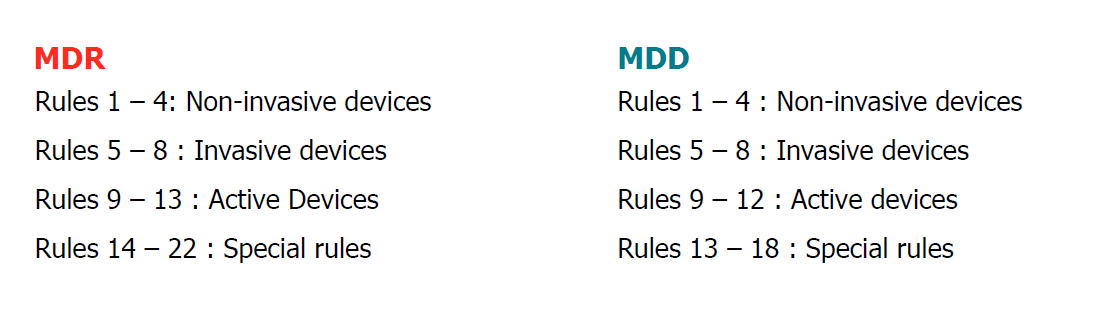
第三步:
根据产品分类,选择MDR认证的符合性评价路径:

总的来说,MDR认证的符合性路径主要变化有三点:
1.对于一类的可重复使用器械,MDD不要求公告机构的介入,但是MDR要求公告机构介入和重复性使用相关的部分,包括清洁、消毒、灭菌、维护、功能测试和使用说明书。
2. 对于III类植入MD以及IIb类预期用于给予/移除药物的有源器械,MDR要求临床评价审核必须经过临床评价咨询程序。也就是临床评价报告的审核需要欧盟委员会的专家组介入,进行双重审核。
3. 对于含药器械,含生物源物质器械以及预期人体吸收/局部分散器械产品,MDR有额外的符合性评价路径要求。
第四步:
按照MDR认证要求更新临床评估报告:
临床评价计划:要求必须开展,可以分阶段,内容包含预期用途,和GSPR的关系,病人组,适应症,禁忌症,临床开发计划,风险收益比,评价风险和副作用等
等同性路径和临床调查
可豁免临床调查的条件必须符合以下三个条件:1.等同产品符合MDR要求,即等同产品已经取得MDR下的CE证书;2. 等同产品的技术资料应能获得;3. 需要有充足的临床数据和证据。
瑞恩尼咨询可提供临床评估编制服务,按照企业现状编制符合发证机构要求的全英文临床评估报告。
第五步:
按照MDR认证更新CE技术文档:
关于MDR对CE技术文档的要求,瑞恩尼咨询往期的有详细的CE技术文档清单介绍,欢迎查阅。
第六步:
按照MDR认证更新质量管理体系文件
MDR增加了向公告机构提交申请的要求(附录9),制造商应向公告机构提供之前注册申请认证情况的解释说明;
对GSPR(设计开发过程)进行细化,增加UDI的要求
上市后监督文件要求:上市后监督计划和上市后临床跟踪计划,定期安全汇总报告PSUR,SSCP报告
增加各经营者的职责,尤其欧盟代表的职责,法规符合性负责人的职责等等。
第七步:
申请SRN,准备UDI等
MDR要求建立欧洲医疗器械数据库(EUDAMED),同时医疗器械注册时相关主体将被分配单一注册号SRN。2020年8月欧盟医疗器械协调小组MDCG发布了关于在欧盟成员国境内使用EUDAMED和SRN的指导文件:MDCG2020-15。
该文件的主要内容如下:
1、2020年12月1日开始,将启用EUDAMED数据库的注册功能模块;
2、预计在2022年5月实现EUDAMED全部功能的运行;
3、EUDAMED其它模块运行的先决条件是注册功能模块;
4、产品不需要在不同成员国主管当局重复注册。
根据医疗器械法规MDR(Regulation (EU) 2017/745):
对于可植入器械和III类器械,自2021年5月26日起适用UDI的要求;
对于IIa和IIb类器械,应自2023年5月26日起适用UDI的要求;
对于I类器械,应自2025年5月26日起适用UDI的要求。
第八步:
按照MDR认证进行自查/内审/管理评审
第九步:
向NB申请MDR认证
深圳市瑞恩尼医疗器械管理咨询有限公司是一家专业从事医疗器械法规咨询、注册代理、质量管理体系建立与提升、企业管理培训与辅导的专业性咨询公司,是目前广东省内口啤最好的医疗器械咨询机构之一。
选择我们,我们将一站式解决您的烦恼,从产品送检至取得证书,全程跟踪。
欢迎您咨询。电话:0755-27391220。
Parent Company:
Shenzhen Reanny Medical Device Management Consulting Co.,Ltd
Address:Room 1407, Jingting Building, Dongzhou Community, Guangming Street, Guangming District, Shenzhen
Guangzhou Branch:
Guangzhou Reanny Medical Device Consulting Co., Ltd
Address:No. 2205, West Block, Building K, Kehui Jingu, No. 99, Kexue Avenue, Huangpu District, Guangzhou

扫一扫,关注我们
