
3月12日,国家药监局发布通告,批准南京诺唯赞、北京金沃夫、深圳华大因源、广州万孚生物、北京华科泰生物的新冠抗原产品自测应用申请变更。自此五款新冠抗原自测产品正式上市。
01
首批5家获批
3月11日晚间,国家卫健委发布消息,经研究,国务院应对新型冠状病毒肺炎疫情联防联控机制综合组决定在核酸检测基础上,增加抗原检测作为补充,并组织制定了《新冠病毒抗原检测应用方案(试行)》。
●《方案》规定了抗原检测的适用人群:一是到基层医疗卫生机构就诊,伴有呼吸道、发热等症状且出现症状5天以内的人员;二是隔离观察人员,包括居家隔离观察、密接和次密接、入境隔离观察、封控区和管控区内的人员;三是有抗原自我检测需求的社区居民。同时,明确了3类人群进行抗原检测需满足的主要条件、检测试剂的获得渠道,制定了检测发现阳性后的处置管理流程,促进抗原检测与核酸检测相衔接。
短短一天之后,五款新冠抗原自测产品正式上市。
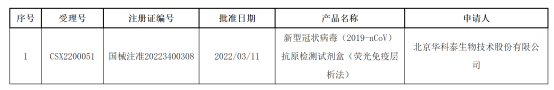
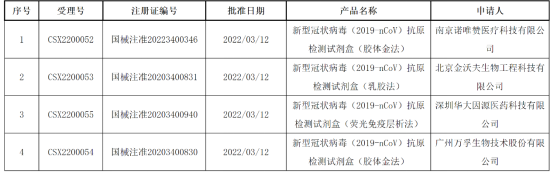
国家药监局网站3月12日发布的医疗器械批准文件(变更)待领取信息显示,由万孚生物、华大基因子公司深圳华大因源医药科技有限公司、北京金沃夫生物工程科技有限公司、南京诺唯赞医疗科技有限公司、北京华科泰生物技术股份有限公司5家公司研发的5款新冠抗原检测试剂盒通过了药监局的注册信息变更。
专业人士处获悉,此次“注册变更”的核心在于,不再限定该检测试剂“仅由专业技术人员使用”。这意味着,相关检测试剂将可用于居家自测等其他场景。
5款新冠抗原检测试剂盒分属5家公司,其中万孚生物、深圳华大因源(华大基因)、诺唯赞均为A股公司,而北京金沃夫和北京华科泰生物尚未登陆资本市场。值得注意的是,北京华科泰生物2019年曾披露创业板IPO招股书,但最终撤回申请。
02
拥有自测条件
事实上,新获批上市的5家公司5款新冠抗原检测试剂盒产品,不少在2020年已获批准,但变更注册信息前均属于专业版本,需要专业人士操作。
具体来看,2020年11月,万孚生物的新型冠状病毒(2019-nCoV)抗原检测试剂盒(胶体金法)和北京金沃夫的新型冠状病毒(2019-nCoV)抗原检测试剂盒(乳胶法),获得国家药监局批注上市,成为国内首批取得医疗器械注册证的相关产品。次月,深圳华大因源研制的新型冠状病毒抗原检测试剂盒(荧光免疫层析法),也取得了医疗器械注册证。
2022年3月初,华科泰生物的新型冠状病毒(2019-nCoV)抗原检测试剂盒(荧光免疫层析法)获批上市,并且很快就具备了大规模供应的产能。
就在《方案》发布当天,诺唯赞医疗发布公告称,全资子公司南京诺唯赞医疗科技有限公司自主研发生产的新型冠状病毒抗原检测试剂盒,近日收到国家药监局颁发的《医疗器械注册证》。
诺唯赞表示,该试剂盒可用于检测新型冠状病毒感染疑似人群口咽拭子、鼻咽拭子样本中新型冠状病毒N抗原和S抗原。上述产品一般用于急性感染期,即疑似人群出现症状7天之内的样本检测,可作为核酸检测的辅助和补充,配合国家新型冠状病毒检测策略,进一步提高“早发现”能力。同时,公司也提醒,试剂盒不可单独用于新型冠状病毒感染的诊断。
至此,国内新冠抗原检测市场上已有5款试剂盒,技术路径覆盖胶体金、乳胶、荧光免疫层析等对仪器环境和操作要求相对简单的多个类型,为《方案》中到基层医疗卫生机构就诊人员开展新冠抗原快速检测提供了可及的选择。
从获批条件来看,前述5款新冠抗原检测产品均属于专业版本。根据《基层医疗机构操作流程》,使用这类专业版本的新冠抗原检测试剂盒,需要有经过生物安全培训合格并熟悉相关要求的采样人员,和具备相关资质的检测人员在特定的环境和仪器设备支撑下完成,并不能用于居家自测。
随着3月12日国家药监局发布医疗器械批准文件(变更)待领取信息,前述5家公司研发的5款新冠抗原检测试剂盒通过了药监局的注册信息变更。专业人士处获悉,此次“注册变更”的核心在于,不再限定该检测试剂“仅由专业技术人员使用”。这意味着,注册变更”后的检测试剂不再限定“仅由专业技术人员使用”,其使用范围进一步扩大,拥有在零售药店、网络销售平台进行销售的资格。
03
已有海外订单
除前述首批5家企业外,我国已有多家企业可量产抗原检测试剂盒,但此前相关产品主要用于出口。据海关总署发布,2021年中国累计向海外出口668.93亿元金额的新冠检测试剂盒,2021年12月全国新冠试剂出口单月超100亿元。迈克生物、华大基因、迪安诊断、明德生物等公司均已斩获海外新冠抗原检测试剂上市资质。
另外,国内已获得美国FDAEUA紧急运用受权的公司包括九安医疗、东方生物和艾康生物。今年1月14日,九安医疗宣布已与美国ACC签署2.5亿人份iHealth新冠抗原家用自测OTC试剂盒产品采购合同。东方生物2021年半年报显现,2021年上半年公司新冠检测试剂(抗原为主)出口收入61.88亿元,约占全国出口新冠试剂总收入13.78%。
第八届中国体外诊断产业开展大会上发布的《2020年中国体外诊断行业报告》显现,将来五年的开展趋向,至少两年内的常规检丈量会有所减少,与新冠相关的核酸检测收入会大量增长,抗体的检丈量会有所动摇,快速抗原检测的需求将会变大,新冠检测业务可能持续至2024年。
Copyright © 2017 深圳市瑞恩尼医疗器械管理咨询有限公司 地址: 深圳市光明区光明街道东周社区璟霆大厦1407室 电话:0755-27391220 粤ICP备17083738号

扫一扫,关注我们
