
生物相容性评价:
需要按照ISO 10993-1的要求进行生物相容性评价,对接触人体的部件和材料进行鉴别和分析,判断什么部位是直接接触,什么部位是间接接触,同时需要提供接触部件的材质组成,分析材质与已在美国上市的同类产品在材质和化学成份上的异同,如无法判定实质等同,需要按照ISO 10993-1附录A和接触时间进行判定需要进行的测试项目。
FDA对于测试机构资质要求:
FDA认可GLP实验室,目前FDA也认可非CLP实验室但是需要实验室出具符合GLP要求的声明,确保测试是在GLP的规范下进行的。在选择测试机构时,我们可以选择有GLP资质和ISO 10993序列标准检测能力的实验室,也可以选择有CNAS资质的且有ISO10993序列标准的检测能力范围测试机构,但是要测试机构出具符合GLP的声明;
送检样品的要求:
测试材料如果不是成品,必须是最终产品的最终形式。
包装要求,有微生物指标要求的产品或无菌产品起码要有初包装;灭菌包装必须标注已灭菌,使用前不需要灭菌的产品标注非灭菌就行,使用前需要用户自己灭菌的,需要按照说明书规定的方法灭菌后再进行检测。
需要提供送检材料或产品的批号,出具的报告必须英文,中英文也可以;
样品材料描述,必须包括所有与人体接触的材料,测试材料或部件的名称,对应的化学材质名称必须都写上,(请注意生物相容性测试需提供最终成品物料,材质及颜色都可能影响测试结果,因此即使材质相同,颜色不同的物料也要测试)
样品的处理:
如果有产品行标规定,按照行标的要求,一般按照ISO 10993-12的要求进行。
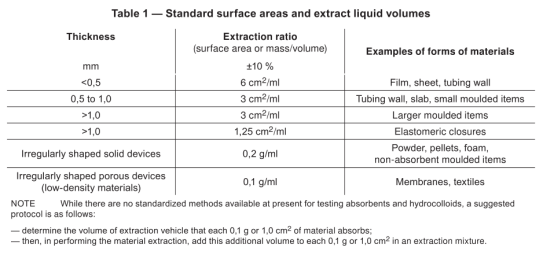
浸提条件(不适宜直接敷贴的产品适用,直接敷贴法只适用于片状薄膜装等湿性物质,如电极、敷料等);细胞毒性:37度24小时或72小时,刺激和致敏:一般为50度 72小时或以上;如果是无法获得表面积的产品,使用重量浸提法,如颗粒、海绵状物质、粉末等,其他必须采用表面积浸提,浸提比例如下:
浸提液(致敏和刺激):极性浸提液+非极性浸提液。
所选择的试验动物,雌雄都可以,但如果选择的是雌性动物,需要注意不能选择怀孕或产仔的动物,这可能会影响测试结果。
最终测试报告要求:
FDA注册的需要有符合GLP要求的声明,而且需要提供三个月内的阳性对照的测试记录,阳性对照的测试方法和材料必须与实验组完全一致。
提供FDA的生物相容性测试必须要提供详细的所有与测试相关的测试材料,详细的测试步骤信息。
Copyright © 2017 深圳市瑞恩尼医疗器械管理咨询有限公司 地址: 深圳市光明区光明街道东周社区璟霆大厦1407室 电话:0755-27391220 粤ICP备17083738号

扫一扫,关注我们
